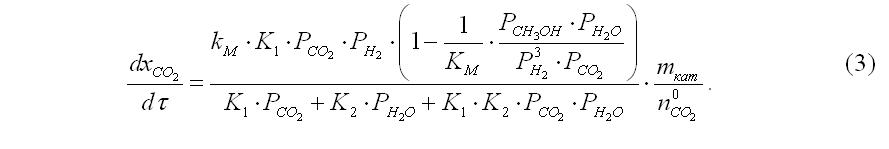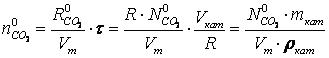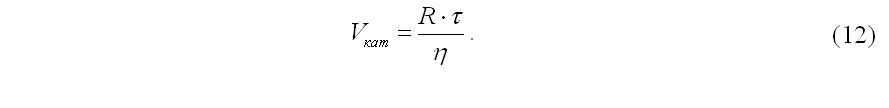Введение
Современные технологии производства метанола (СМ) основываются на его синтезе, главным образом, из смеси СО + СО2 + Н2 + инертные компоненты, на оксидных медьсодержащих низкотемпературных катализаторах при 200 – 290 °С под давлением 5,0 – 10,0 МПа. Синтез проводят в проточных многополочных реакторах, которые располагают в циркуляционных схемах [1]. Сложность процесса синтеза, наличие нескольких возможных механизмов и многих кинетических уравнений обусловливают альтернативные подходы к виду математической модели и способов ее решения.
Анализ литературы
На протяжении длительного времени считалось, что углерод в молекуле CH3ОН происходит из молекулы оксида углерода (II) [2]. Однако в 1975 году Розовским А. Я. и Лин Г. И. [3] на основе фундаментальных исследований с помощью методов относительных селективности, меченых атомов, а также прямого эксперимента установлен иной макромеханизм процесса образования метанола, который не предусматривался классическими концепциями. Этими учеными доказано, а затем другими исследователями подтверждено: на оксидных катализаторах собственно СМ протекает путем гидрирования СО2 (а не СО, как это считалось ранее) с образованием метанола и воды:
Наиболее популярными направлениями моделирования СМ является оптимизация работы реакторов, модернизация технологических схем и разработка систем управления промышленным процессом. Так, в работах зарубежных авторов [4 – 6] моделируется работа многотрубного и радиального реакторов СМ и изучается влияние изменения структуры потоков на производительность по целевым компонентом. Отметим также разработку системы управления процессом синтеза метанола с комбинированной моделью для внедрения на ОАО «Северодонецкое объединение Азот» [7].
Более близкими к нашему исследованию являются работы [8 – 11]. Работы [8 –10] содержат информацию об адаптации и использования одной из кинетических моделей образования CH3OH из СО и данные о составе промышленного технологического газа. Кроме того, в работе [9] предложены варианты учета степени дезактивации катализатора и реконструкции установки с внедрением в технологическую схему реактора предкатализа. Авторы статьи [11] для расчетов использовали кинетическую модель, предусматривающую образование метанола из СО2. Ими предложены и математически подтверждены незначительные модернизации технологической схемы и изменения направлений газовых потоков.
Постановка задачи
Наши расчеты основаны на модели авторов [3], что предусматривает образование метанола из СО2. Уравнения скоростей СМ и конверсии СО в СО2 имеют вид, соответственно:

где WM – скорость синтеза метанол, моль/(т∙с);
WK – скорость образования диоксида углерода, моль/(т∙с);
mкam – масса катализатора, т;
τ– время, с;
nCH3OH , nCO2 – количество вещества СН3ОН и СО2, соответственно, моль;
kM , kK – константы скоростей реакций образования метанола и диоксида углерода, моль/(т∙с∙МПа);
K1, K2 – константы равновесия стадий адсорбции СО2 и H2O, соответственно, МПа‑1;
Pi – текущие парциальные давления участников реакций, МПа.
Материалы исследований
Задачей осуществляемого расчета является определение объема катализатора, необходимого для получения заданного выхода метанола. Первым шагом к решению этой задачи является определение времен контакта газовой смеси со слоями катализатора, необходимых для достижения определенного значения содержания метанола на выходе каждой из четырех полок. Эта цель достигается путем решения системы дифференциальных уравнений (1) и (2). Для проведения численного интегрирования этой системы необходимо осуществить математические преобразования с правыми и левыми частями этих уравнений таким образом, чтобы остались только два неизвестных (не считая время τ).
Одним из вариантов такого преобразования есть такой, при котором левые части составят выражения dxCO2/dτ и dxCO/dτ, а все парциальные давления после знаков «равно» будут выражены через эти две степени превращения по диоксиду xCO2 и оксиду углерода xCO, соответственно.
Для реализации этого замысла выполняются следующие шаги:
- обе части уравнения (1) умножаются на массу катализатора mкaт;
- из выражения текущего количества метанола, моль:
После подстановки полученного выражения в уравнение скорости образования метанола и деления обеих его частей на исходную концентрацию n0CO2 получаем искомую левую часть:
Аналогичным образом проводим преобразования с кинетическим уравнением (2) образования СО2. В результате получаем:
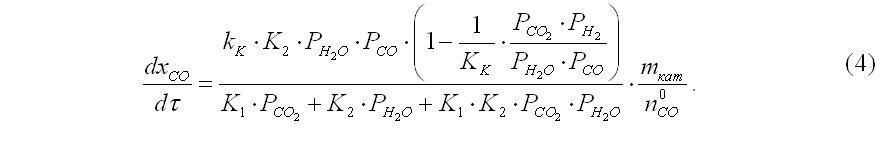
Текущие парциальные давления участников преобразований, если пренебречь изменением объема газовой смеси, выражаются через степени превращения СО2 и СО следующим образом:
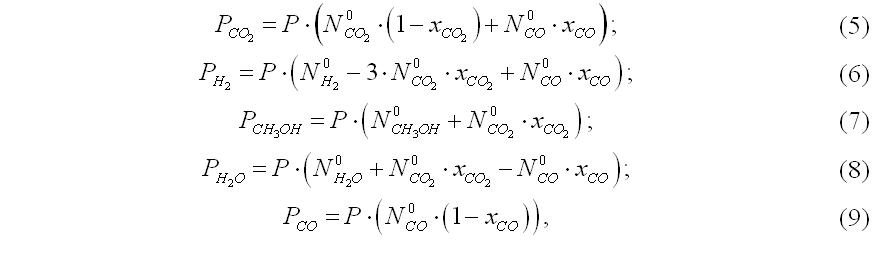
где Ni0– молярные доли участников процесса в исходной смеси;
P– давление процесса, МПа.
Величины, фигурирующие в уравнениях (1) и (2), представляют собой количества (моль) СО2 и СО, соответственно, контактирующих с катализатором в каждый момент времени τ для заданного расхода газовой смеси и значений начальных концентраций:
где R0CO2, R – расход диоксида углерода и исходной газовой смеси, соответственно, при нормальных условиях, м3/с;
Vкат, mкат, ρкат — соответственно объём, масса и насыпная плотность катализатора загруженного в реактор, м3, т, т/м3;
Vт — молярный объём идеального газа, м3/моль (Vт = 0,0224).
Выражение для количества n0CO получено аналогично:
После соответствующих замен в уравнениях (3) и (4) и несложных упрощений получаем окончательный вариант системы, который можно использовать непосредственно для расчетов:
Численное интегрирование полученной системы уравнений (10 – 11) с помощью функции MathCAD rkfixed дает возможность построить графики xCO2 = f(τ) и xCO = f(τ) на одной координатной плоскости и N(CO2)= f(τ), N(H2) = f(τ), N(CH3OH) = f(τ), N(H2O) = f(τ), N(CO)= f(τ) на другой. Из второго графика определяем время контакта, необходимое для обеспечения заданной объемной (молярной) доли метанола на выходе из полки.
По времени контакта рассчитывается объем катализатора на каждой из полок с учетом степени использования поверхности η, м3:
После этого, используя уравнения (5 – 9), рассчитываем состав (% об.) газа на выходах из полок. Значения степеней превращения берутся из таблицы результатов работы функции rkfixed – соответствующие определенному из графика времени контакта. Из-за пренебрежения изменением объема системы рассчитанная молярная доля метанола на выходе из полки может отличаться от ожидаемой концентрации. В таком случае надо корректировать значения времени и по тому же принципу найти новые значения степени превращения.
Результаты исследований
Проведен расчет по следующим исходным данным, при этом состав газа (табл. 1) по полкам взят из материального баланса, составленного авторами данной статьи: давление процесса, МПа – 5; насыпная плотность катализатора, т/м3 – 1,3; степень использования поверхности катализатора, доля – 0,5. Постоянные кинетических уравнений (10) и (11) при температуре синтеза 240 °С и при 30% степени дезактивации катализатора [3]:
kM = 4,1 мкмоль СН3ОН/(г кат-ра∙с∙МПа);
kK = 4,15∙ мкмоль СО2/(г кат-ра∙с∙МПа);
K1 = 18 МПа-1; = 23 МПа-1.
Таблица 1 – Исходные данные
|
Параметр |
1 полка |
2 полка |
3 полка |
4 полка |
|
Расход газа на входе, м3/ч |
891000 |
924200 |
957300 |
990500 |
|
Температура на входе Tвх, К |
513 |
518,5 |
523,5 |
528 |
|
Концентрация CH3OH после полки, доля |
0,01 |
0,016 |
0,022 |
0,027 |
|
Концентрация СО2 на входе, доля |
0,2282 |
0,2291 |
0,2301 |
0,2308 |
|
Концентрация СОна входе, доля |
0,2027 |
0,2011 |
0,2003 |
0,1978 |
|
Концентрация Н2 на входе, доля |
0,4630 |
0,4539 |
0,4468 |
0,4357 |
|
Концентрация СН3ОНна входе, доля |
0,0041 |
0,0100 |
0,0160 |
0,0210 |
|
Концентрация Н2Она входе, доля |
0,0009 |
0,0030 |
0,0040 |
0,0070 |
|
Концентрация инертных газов на входе, доля |
0,1011 |
0,1029 |
0,1028 |
0,1077 |
Полученные результаты сведены в табл. 2. В статье [8] авторами приведены промышленные данные и данные собственного адекватного расчета работы установки М-750 ООО «Сибметахим», г. Томск. Эти данные (табл. 3) были использованы нами для апробации созданной программы на альтернативных исходных условиях синтеза. В табл. 3 приведены результаты проведенного нами расчета по вышеприведенному алгоритму и сопоставлены с литературными и промышленными данными.
Таблица 2 – Результаты расчета
|
Параметр |
1 полка |
2 полка |
3 полка |
4 полка |
| Концентрация CH3OH на выходе полки, доля (исходные данные) |
0,01 |
0,016 |
0,022 |
0,027 |
| Концентрация СО2 на входе, % |
22,82 |
22,91 |
23,01 |
23,08 |
| Концентрация СО2 на выходе, % |
22,49 |
22,70 |
22,84 |
23,11 |
| Концентрация СОна входе, % |
20,27 |
20,11 |
20,03 |
19,78 |
| Концентрация СОна выходе, % |
20,52 |
20,24 |
20,12 |
19,67 |
| Концентрация Н2 на входе, % |
46,30 |
45,39 |
44,68 |
43,57 |
| Концентрация Н2 на выходе, % |
45,01 |
44,24 |
43,56 |
42,67 |
| Концентрация СН3ОН на входе, % |
0,41 |
1,00 |
1,60 |
2,10 |
| Концентрация СН3ОН на выходе, % |
1,04 |
1,62 |
2,22 |
2,71 |
| Концентрация Н2О на входе, % |
0,09 |
0,30 |
0,40 |
0,70 |
| Концентрация Н2О на выходе, % |
0,71 |
0,79 |
0,85 |
0,95 |
| Концентрация инертных газов на входе, % |
10,11 |
10,29 |
10,28 |
10,77 |
| Концентрация инертных газов на выходе, % |
10,24 |
10,41 |
10,40 |
10,90 |
| Время контакта, с |
0,038 |
0,042 |
0,048 |
0,059 |
| Степень превращения СО2, % |
2,7 |
2,6 |
2,6 |
2,5 |
| Степень превращения СО, % |
0,03 |
0,56 |
0,77 |
1,7 |
| Объём катализатора, м3 |
18,8 |
21,6 |
25,5 |
32,5 |
| Σ, м3 |
98,4 |
|||
| Производительность по CH3OH (ректификат), т/ч |
32,05 |
|||
Таблица 3 – Сравнение результатов собственного расчета с литературными и промышленными данными
|
Технологичный поток |
Концентрация, %об. |
||||||
|
CO |
CO2 |
H2 |
CH3OH |
H2O |
Инерты | ||
|
Промышлен-ные данные |
Вход на 1 полку |
3,069 |
2,000 |
82,483 |
0,475 |
0,077 |
11,896 |
|
Расчет [8] |
Выход из 1 полки |
1,695 |
1,298 |
80,879 |
2,807 |
0,875 |
12,446 |
|
Наш расчет |
Выход из 1 полки |
1,644 |
1,351 |
80,933 |
2,805 |
0,822 |
12,445 |
|
Расчет [8] |
Вход на 2 полку |
2,083 |
1,496 |
81,332 |
2,148 |
0,650 |
12,291 |
|
Выход из 2 полки |
1,065 |
1,127 |
80,361 |
3,705 |
1,083 |
12,659 |
|
|
Наш расчет |
Выход из 2 полки |
1,019 |
1,188 |
80,427 |
3,690 |
1,022 |
12,654 |
|
Расчет [8] |
Вход на 3 полку |
1,569 |
1,346 |
80,894 |
2,893 |
0,830 |
12,468 |
|
Выход из 3 полки |
0,543 |
0,908 |
79,821 |
4,538 |
1,336 |
12,854 |
|
|
Наш расчет |
Выход из 3 полки |
0,518 |
0,92 |
79,826 |
4,552 |
1,324 |
12,859 |
|
Расчет [8] |
Вход на 4 полку |
1,076 |
1,138 |
80,382 |
3,681 |
1,070 |
12,653 |
|
Выход из 4 полки |
0,321 |
0,724 |
79,461 |
4,994 |
1,538 |
12,962 |
|
|
Наш расчет |
Выход из 4 полки |
0,346 |
0,777 |
79,547 |
4,907 |
1,481 |
12,942 |
|
Промышлен-ные данные |
Выход из 4 полки |
0,410 |
0,706 |
79,472 |
4,898 |
1,565 |
12,949 |
Сравнение результатов расчета с промышленными и литературными данными [8] показывает возможность адекватного использования созданных нами алгоритма и программы.
Выводы
Разработаны алгоритм и программа для расчета синтеза метанола в многополочном реакторе на основе современных представлений о механизме его образования на медь-цинк-алюминиевом катализаторе. Адекватность программы проверена на двух существенно отличающихся наборах промышленных данных. Полученные результаты подтверждают возможность использования алгоритма и разработанной программы в среде MathCAD для многовариантных расчетов времени контакта, объема катализатора и содержания компонентов на выходе каждой полки.
Библиографический список
- Товажнянський Л. Л. Технологія зв’язаного азоту: Підручник / За ред. Л. Л. Товажнянського, О. Я. Лобойко. – Харків: НТУ “ХПІ”, 2007. – 536 с.
- Караваев М. М. Технология синтетического метанола: Учеб. пособ. / М. М. Караваев, В. Е Леонов, И. Г. Попов / Под ред. М. М. Караваева. – М.: Химия, 1984. – 240 с.
- Розовский А.Я. Теоретические основы процесса синтеза метанола: Учеб. пособ. / А. Я. Розовский, Г. И. Лин – М.: Химия, 1990. – 271 с.
- Montebelli A.. Optimization of compact multitubular fixed-bed reactors for the methanol synthesis loaded with highly conductive structured catalysts / [A. Montebelli, C. G. Visconti, G. Groppi et al.] // Chemical Engineering Journal. №255. – 2014. – P. 257 – 265.
- Lei K. Study on Effective Radial Thermal Conductivity of Gas Flow through a Methanol Reactor / [K. Lei, H. Ma, H. Zhang et al.] // Int. J. Chem. React. Eng. №13(1). – 2015. – P. 103 – 112.
- Manenti F. Systematic staging design applied to the fixed-bed reactor series for methanol and one-step methanol/dimethyl ether synthesis / [F. Manenti, A. R. Leon-Garzon, Z. Ravaghi-Ardebili et al.] // Applied Thermal Engineering. v.70, №2. – 2014. – P 1228 – 1237.
- Абдалхамид Д. Адаптация математической модели реактора синтеза метанола / Д. Абдалхамид, М. Г. Лория, А. Б. Целищев и др. // Восточно-Европейский журнал передовых технологий. – 2013. –№ 6/3 (66). – С. 4 – 6.
- Попок Е. В. Моделирование промышленного реактора низкотемпературного синтеза метанола / Е. В. Попок, Е. М. Юрьев, А. В. Кравцов // Фундаментальные исследования. – Химические науки. – 2012. – №3. – С. 446 – 451.
- Коробочкин В. В. Повышение эффективности установок синтеза метанола с использованием метода математического моделирования / В. В. Коробочкин, А. В. Кравцов, Е. В. Попок // Фундаментальные исследования. – Технические науки. – 2012. – №9. – С. 151 – 156.
- Концевой А.Л. Математическая модель колонны синтеза метанола. / А.Л. Концевой, С.А. Концевой // Проблемы современной науки и образования №11 (41), 2015, с. 13 – 17
- Мещеряков Г. В. Синтез метанола с двумя трубчатыми реакторами и отбором продуктов синтеза после каждого реактора / Г. В. Мещеряков, Ю. А. Комиссаров, В. А. Мишанова // Башкирский химический журнал. – 2012. – Том 19, №1. – С. 113 – 115.