Сорбционные методы очистки сточных вод и извлечение ценных компонентов из сбросных и технологических растворов в последнее время получают все большее распространение вследствие высокой эффективности метода.
Перспективным природным сорбентом являются железомарганцевые конкреции (ЖМК) [1-7], обладающие высокой емкостью, удельная поверхность ЖМК составляет 43,81 м2/г [8].
Величину сорбции Г (моль·кг-1) катионов определяли в статических условиях при отношении объема жидкой фазы к массе твердой V/m=10 дм3·кг-1 и массе навески ЖМК 5 г по разности концентраций исходного С0 и равновесного Ср растворов по формуле:
![]() , (1)
, (1)
где ρ – плотность раствора в кг·дм-3.
Раствор соли металла перемешивали с навеской ЖМК до равновесного состояния при постоянной температуре 298 К. Время установления равновесия, отвечающее постоянству концентрации раствора, составляло 5-6 ч., в опытах время контакта фаз устанавливали не менее 10 ч.
После опыта в отделенном через фильтр «синяя лента» растворе определяли равновесные концентрации ионов натрия с помощью ионоселективного электрода и концентрацию катионов по стандартным методикам.
Изотермы ионного обмена катионов Сu2+, Pb2+, Co2+ на Na+ на ЖМК из индивидуальных растворов представлены на рис. 1.
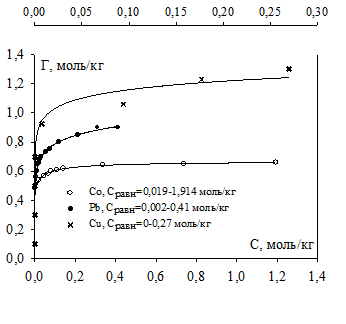
Рисунок 1. Изотермы сорбции катионов Сu2+, Pb2+, Co2+на Na+ на ЖМК
Термодинамическое описание ионного обмена катионов металлов и натрия на ЖМК было проведено при допущении идеальности твердой фазы, т.е. без учета коэффициентов активности ионов в сорбированном состоянии. Использовали уравнения, полученные преобразованием уравнения закона действующих масс. Так как в данной работе исследовались металлы со степенью окисления (2+), уравнение закона действующих масс для реакции ионного обмена
имеет вид:
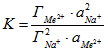 , (2)
, (2)
где К – кажущаяся константа обмена, ![]() и
и ![]() – величины сорбции ионов (моль·кг-1),
– величины сорбции ионов (моль·кг-1), ![]() и
и ![]() активности ионов в растворе (моль·кг-1). Значение предельной сорбции ионов равно:
активности ионов в растворе (моль·кг-1). Значение предельной сорбции ионов равно:
![]() , (3)
, (3)
где ![]() - величина предельной сорбции ионов в молях Me2+ на 1 кг сухих ЖМК, значения сорбции ионов выражены в моль·кг-1. Уравнение (2) может быть приведено к виду:
- величина предельной сорбции ионов в молях Me2+ на 1 кг сухих ЖМК, значения сорбции ионов выражены в моль·кг-1. Уравнение (2) может быть приведено к виду:
.gif) (4)
(4)
Уравнение (4) преобразовали в формулу (5):
.gif) (5)
(5)
Линейная форма уравнения имеет вид:
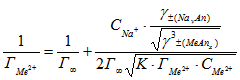 (6)
(6)
Для вычисления значения предельной сорбции ионов строилась зависимость обратной величины сорбции ионов металлов ![]() от аргумента
от аргумента.gif) .
.
Кажущуюся константу ионообменной сорбции вычисляют по формуле:
![]() , (7)
, (7)
где ![]() - угловой коэффициент зависимости
- угловой коэффициент зависимости ![]() , а Г8
, а Г8
находят по величине свободного члена этой зависимости.
Энергию Гиббса ионного обмена рассчитывали по формуле:
![]() (8)
(8)
По величине удельной поверхности ЖМК, определенной нами, Sуд = 43,81 м2·г-1 и предельной сорбции катионов оценили «посадочную площадку» ионов:
![]() м2. (9)
м2. (9)
Отсюда вычисляли радиус сорбированного катиона.
Для вычисления значения предельной сорбции строилась зависимость обратной величины сорбции ионов металлов ![]() от аргумента
от аргумента .gif) (рис. 2).
(рис. 2).
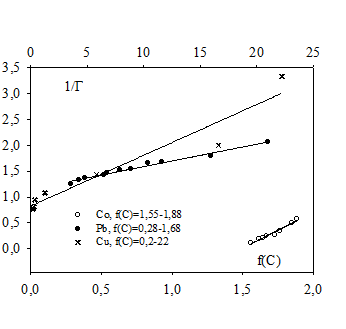
Полученные значения представлены в таблице 1.
Таблица 1. Константы ионного обмена, энергии Гиббса ионного обмена, значения предельной сорбции и радиусы сорбированных катионов.
| Pb2+ | Co2+ | Cu2+ | |
|
Г8 , моль/кг
|
0,866 | 0,667 | 1,43 |
|
K
|
4,50 | 4,64 | 43,8 |
|
G0298, кДж·моль-1
|
-3,72 | -3,81 | -9,38 |
| rsоrb , пм | 163 | 186 | 127 |
В таблице 2 приведены значения радиусов исследуемых катионов: кристаллографические радиусы по Бокию, полученные радиусы сорбированных катионов и радиусы гидратированных катионов, вычисленные по уравнению Стокса (10)
где ![]() - заряд катиона металла, F – постоянная Фарадея, η – вязкость воды,
- заряд катиона металла, F – постоянная Фарадея, η – вязкость воды, ![]() - предельная эквивалентная электропроводность катиона металла.
- предельная эквивалентная электропроводность катиона металла.
Таблица 2. Радиусы катионов
|
катион
|
rcr [2] по Бокию, пм
|
raq по Стоксу, пм
|
rsorb (радиус сорбированного катиона), пм
|
|
Cu2+
|
80
|
324
|
127
|
|
Pb2+
|
125
|
262
|
163
|
|
Co2+
|
78
|
340
|
186
|
Как видно из таблицы 2, полученные значения радиусов катионов, адсорбированных на ЖМК, имеют значения, промежуточные между кристаллографическими радиусами катионов по Бокию и радиусами гидратированных катионов по Стоксу, поэтому их можно рассматривать как средние эффективные радиусы частично дегидратированных ионов.
Степень дегидратации можно оценить по формуле (11):
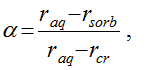 (11)
(11)Величина степени дегидратации изменяется от 0 при rsorb = raq до 1 при rsorb = rcr. Логично объяснить увеличение степени дегидратации повышением прочности электростатических взаимодействий катионов, находящихся в слое Штерна–Гельмгольца, с отрицательно заряженными активными центрами поверхности ЖМК. Последние образуются на гидролизованной поверхности марганцевых минералов вследствие диссоциации манганиольных групп =Mn – OH. Согласно данным, приведенным в литературе, значения pH изоэлектрического состояния марганцевых минералов в составе ЖМК равны 1,5-2,8. Следовательно, в условиях проведенных опытов поверхность ЖМК была заряжена отрицательно. Прочность кулоновских взаимодействий в двойном электрическом слое должна коррелировать с повышением ионного потенциала катионов в сорбированном состоянии и с понижением энергии Гиббса ионообменной сорбции. Это подтверждается составленным на основе полученных результатов рядом вытеснительной способности катионов, приведенным в таблице 3. В качестве основного критерия сорбционной способности катионов при составлении лиотропного ряда было принято понижение энергии Гиббса ионообменной сорбции, поэтому наблюдаются отличия от аналогичных рядов, составленных по возрастанию емкости.
Таблица 3. Лиотропный ряд катионов
| Na+< | Sr2+[6]< | Pb2+< | Co2+< | Ni2+[7]< | Cu2+ | |
| G0298, кДж·моль-1 |
0 | -1,69 | -3,72 | -3,81 | -5,66 | -9,38 |
| Г8 , моль/кг | - | 0,480 | 0,866 | 0,667 | 1,24 | 1,43 |
| z/rsorb·103, пм-1 | 5,46 | 9,0 | 12,3 | 10,75 | 13,6 | 15,7 |
| rsоrb , пм | 183 | 219 | 163 | 186 | 136 | 127 |
Вдоль ряда сорбционной способности катионов, или лиотропного ряда (согласно терминологии, предложенной академиком К.К. Гедройцем), с понижением энергии Гиббса ионного обмена растет вытеснительная способность катионов. В первом приближении наблюдается корреляция с изменением ионного потенциала сорбированных катионов и степени их дегидратации.
Выводы
1. Изотермы ионообменной сорбции катионов Cu2+, Pb2+ и Co2+ на ионы Na+ на поверхности ЖМК описываются уравнением, полученным преобразованием уравнения закона действующих масс, и могут быть представлены в линейном виде:
2. Определены кажущиеся константы ионообменной сорбции для ионов Cu2+, Pb2+, Co2+на катионы Na+ на ЖМК:![]() ;
; ![]() ;
; ![]() .
.
3. Рассчитаны значения предельной сорбции ионов Cu2+, Pb2+, Co2+ ,
![]() 1,43 моль·кг-1,
1,43 моль·кг-1, ![]() 0,866 моль·кг-1,
0,866 моль·кг-1, ![]() 0,667 моль·кг-1.
0,667 моль·кг-1.
4. Получены значения дифференциальной энергия Гиббса ионообменной сорбции для ионов Cu2+, Pb2+, Co2+ на катионы Na+ на ЖМК:
для
для
5. Оценены посадочные площадки и значения радиусов сорбированных катионов:
6. Радиусы сорбированных катионов имеют значения, промежуточные между кристаллографическими радиусами катионов по Бокию и радиусами гидратированных катионов в водном растворе по Стоксу, что соответствует представлению о сорбции катионов на поверхности ЖМК в слое Штерна–Гельмгольца в частично дегидратированном состоянии.
Результаты были получены в рамках выполнения государственного задания Минобрнауки России по проекту № 982 «Развитие термодинамической и кинетической теории межфазного ионного обмена применительно к природным и промышленным объектам» от 11.06.2014г.
Библиографический список
- Челищев Н.Ф., Грибанов Н.К., Новиков Г.В. Сорбционные свойства океанических железомарганцевых конкреций и корок // М.: Недра. 1992.- С. 7-23, 316.
- Краткий справочник физико-химических величин./ Под ред. А.А. Равделя и А.М. Пономаревой. Л.: Химия. 2002. С. 123, 130, 200. 232 231 с.
- Челищев Н.Ф., Грибанова Н.К., Новиков Г.В. // Обогащение руд. 1988. № 3. С. 32 – 34.
- Зарицкий В.П. // Конкреции и конкреционный анализ: Сб. статей. М.: Наука, 1977. С 84-89, 245 с.
- Новиков Г.В., Сироткина И.В. / Сорбционный механизм формирования химического состава океанских железомарганцевых рудных отложений. Журнал «Вестник Отделения наук о Земле РАН» №1(22) 2004 С. 38-42.
- Чиркст Д.Э., Черемисина О.В., Иванов М.В., Чистяков А.А., Жадовский И.Т., /Изотерма обмена катионов стронция и натрия на железомарганцевых конкрециях // ЖПХ. 2006. Т. 79. № 3. С.374-379.
- Чиркст Д.Э., Черемисина О.В., Иванов М.В., Чистяков А.А., Жадовский И.Т., / Изотерма обмена катионов никеля и натрия на поверхности.// ЖМК ЖПХ. 2006. Т. 79. № 7. С.1101-1105.
- Чиркст Д.Э., Черемисина О.В., Иванов М.И., Чистяков А.А./ Изотерма стронция // ЖПХ. 2005, Т. 78. № 4. С. 599-605
