В настоящее время все более широкое распространение получает сорбционное извлечение металлов из сбросных технологических растворов и сточных вод вследствие высокой эффективности метода и отсутствия вторичных загрязнений.
Перспективным природным сорбционном материалом для очистки сточных вод и сбросных технологических растворов являются железомарганцевые конкреции (ЖМК) [1-8], емкость по железу (2+) ЖМК составляет от 46,34 до 123,56 г/кг (в расчете на сухой сорбент) против 3,25 г/кг импортного аналога типа «Аквамандикс» [9], удельная поверхность составляет 43,81 м2/г. В данной работе исследовали скорость ионного обмена катионов ртути на катионы натрия на поверхности ЖМК.
Известно, что при производстве хлора и каустика ртутным методом в сточных водах находится значительное количество катионов ртути.
Скорость ионного обмена катионов Hg (2+) и Na+ на ЖМК изучали в статических условиях. В термостат помещали колбу, заполненную исследуемым раствором соли Hg(NO3)2 с концентрацией 0,023 – 0,025 моль/л, и термостатировали при различных температурах и соотношениях объема жидкой фазы V (мл) к массе твердого образца m (г) V/m=100; 400.
По экспериментальным данным были построены кинетические зависимости концентрации ионов Hg2+ в исследуемом растворе от времени ионного обмена катионов для V/m=100 при гранулометрическом составе ЖМК от 0,63 до 1,00 мм, скорости перемешивания 400 об·мин-1 и при температурах 288, 303, 323 К. Результаты эксперимента представлены на рисунке 1.
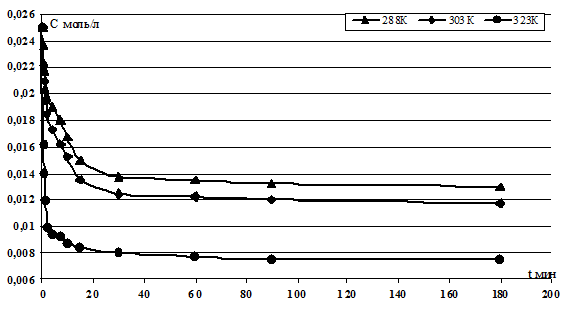
Рисунок 1. Экспериментальная зависимость концентрации Hg2+ от времени процесса ионного обмена при температурах 288, 303, 323 К, V/m=100 для ЖМК грансостава -1,0+0,63мм и скорости перемешивания 400 обмин-1
Обработка кинетических данных процесса ионного обмена катионов при использовании уравнения реакции первого порядка ![]() (С0, Сτ – начальная и текущая концентрации катиона Hg2+, k-константа скорости процесса ионного обмена, τ- время процесса ионного обмена) привела к прямолинейной зависимости в интервале времени τ = 2 15 мин для температур 288 и 303 К и в интервале времени τ = 1 10 мин для 323 К.
(С0, Сτ – начальная и текущая концентрации катиона Hg2+, k-константа скорости процесса ионного обмена, τ- время процесса ионного обмена) привела к прямолинейной зависимости в интервале времени τ = 2 15 мин для температур 288 и 303 К и в интервале времени τ = 1 10 мин для 323 К.
При времени ионного обмена катионов менее 2 минут процесс протекал с большой скоростью в нестационарном режиме. В начальный момент времени, когда ЖМК вносили в раствор, концентрация Hg2+ на их поверхности CS=0, и градиент концентрации в слое Нернста максимален. Затем, с ростом CS, скорость диффузии и скорость процесса ионного обмена выравниваются, и устанавливается постоянный градиент концентрации. Процесс переходит в стационарный режим. Поэтому при обработке результатов для температур 288 и 303 К за исходную принимали концентрацию Hg2+ при τ = 2 мин.
При времени сорбции более 15 минут процесс вновь переходит в нестационарный режим, так как поверхностная концентрация CS выходит на равновесное значение, и градиент концентрации в слое Нернста начинает уменьшаться. Так как с ростом температуры скорость реакции возрастает, при 323 К соответствующим стационарному режиму принимали временной отрезок τ от 1 до 10 мин.
Были получены линейные зависимости величины ![]() от времени процесса ионного обмена τ в секундах, приведенные на рисунке 2.
от времени процесса ионного обмена τ в секундах, приведенные на рисунке 2.
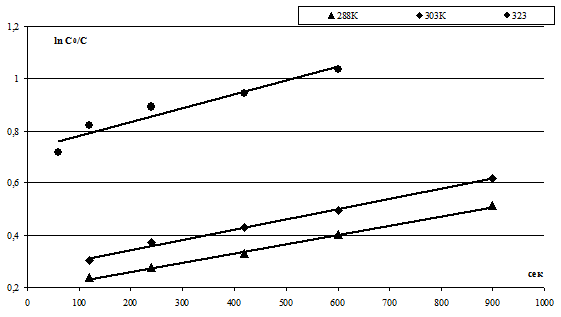
Зависимости величины
По тангенсу угла наклона были найдены величины констант скорости процесса ионообменной сорбции k, приведенные в таблице 1.
Таблица 1 Константы скорости ионного обмена катионов Hg2+ и Na+ на ЖМК при температурах 288, 303, 323 К.
|
V/m
мл/г |
Гранулометрический состав ЖМК, мм
|
Число оборотов мешалки, обмин-1
|
Температура процесса, К
|
Константа скорости внешней диффузии k, с-1
|
|
100
|
-1,00+0,63
|
400
|
288
|
3,5410-4
|
|
303
|
3,910-4
|
|||
|
323
|
5,2710-4
|
В диапазоне τ > 15 мин были рассчитаны зависимости величины степени извлечения F, равной ![]() , где С0, Сτ, С – начальная, текущая и равновесная концентрации катиона Hg2+, от квадратного корня из времени процесса ионного обмена
, где С0, Сτ, С – начальная, текущая и равновесная концентрации катиона Hg2+, от квадратного корня из времени процесса ионного обмена ![]() , которые оказались непрямолинейными. Следовательно, интервалу времени τ > 15 мин. соответствует промежуточная кинетическая область, определяемая соотношением скоростей внешней и внутренней диффузии катионов Hg2+.
, которые оказались непрямолинейными. Следовательно, интервалу времени τ > 15 мин. соответствует промежуточная кинетическая область, определяемая соотношением скоростей внешней и внутренней диффузии катионов Hg2+.
Для подтверждения вывода о внешнедиффузионном механизме процесса провели ионный обмен при соотношении объема жидкой фазы V (мл) к массе твердого образца m (г) V/m= 400 и гранулометрическом составе ЖМК -1,0+0,63мм при температуре 303 К и скорости перемешивания 400 об·мин-1.
Кинетические зависимости концентрации катионов Hg2+ в исследуемом растворе от времени процесса ионного обмена аналогично интерпретировали уравнениями первого порядка.
В диапазоне τ = 2 15 мин при 303 К и скорости перемешивания 400 об·мин-1 были получены линейные зависимости величины ![]() от времени процесса ионного обмена τ, рисинок 3.
от времени процесса ионного обмена τ, рисинок 3.
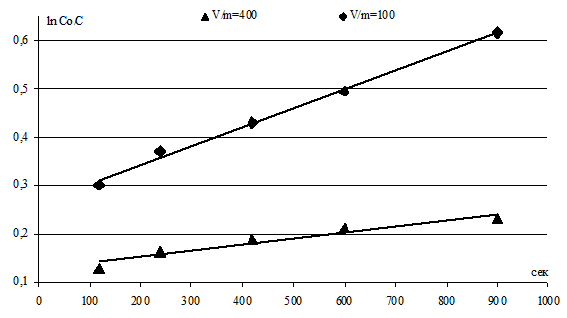 Рисунок 3
Рисунок 3Зависимость величины
Константы скорости процесса ионного обмена катионов Hg2+ и Na+ на ЖМК в зависимости от соотношения V/m приведены в таблице 2.
Таблица 2 Константы скорости ионообменной сорбции катионов, энергия активации, радиусы катионов по Стоксу и Бокию.
|
Катион
|
k c-1
|
Еа, кДж/моль
|
|
|
|
Ni2+ [8]
|
1,710-3
|
7,43
|
340
|
74
|
|
Mn2+ [11]
|
0,93·10-3
|
7,15
|
343
|
91
|
|
Hg2+
|
3,910-4
|
9,27
|
289
|
112
|
|
Pb2+ [10]
|
9,910-5
|
14,64
|
262
|
125
|
Как видно из таблицы 2, константа скорости внешней диффузии k возрастает с уменьшением соотношения V/m, так как возрастает отношение S/V. Этим подтверждается внешнедиффузионный механизм процесса.
Значение энергии активации определяли используя логарифмическое уравнение Аррениуса:
![]()
Согласно уравнению и определенным значениям констант скорости построили графическую зависимость логарифма величины константы скорости процесса от величины обратной температуры: ![]() , которая является прямолинейной, рисунок 4
, которая является прямолинейной, рисунок 4
.gif)
По угловому коэффициенту ![]() рассчитали значение энергии активации и уравнения Аррениуса, которое составило
рассчитали значение энергии активации и уравнения Аррениуса, которое составило ![]() . Низкое значение энергии активации согласуется с тем, что лимитирующей стадией процесса является внешняя диффузия.
. Низкое значение энергии активации согласуется с тем, что лимитирующей стадией процесса является внешняя диффузия.
В таблице 2 сопоставлены значения полученных нами кинетических параметров с имеющимися в литературе аналогами. Там же приведены кристаллографические радиусы по Бокию [2] и радиусы гидратированных катионов, рассчитанные по формуле Стокса:
Катионы по скорости стационарной диффузии располагаются в следующий ряд подвижности:
В ряду подвижности увеличивается константа скорости и уменьшается энергия активации диффузии. При этом возрастают значения радиусов катионов по Стоксу, что противоречит представлению о диффузии катионов в слое Нернста в гидратированном состоянии. Радиусы катионов по Бокию, напротив, в ряду подвижности уменьшаются. Как в случае с катионами Pb2+, описанном в [10], понижение скорости диффузии при переходе к катионам Hg2+ и далее к катионам Ni2+ [8] нельзя объяснить и увеличением массы частиц, так как согласно уравнению Стокса-Эйнштейна коэффициент диффузии определяется не массой, а размером частиц. Обращает внимание уменьшение кристаллографического радиуса в ряду подвижности при переходе от катионов Pb2+ к катионам Hg2+ и далее к катионам Ni2+. Это подтверждает сделанное предположение, согласно которому катионы при диффузии в неподвижном приповерхностном слое раствора передвигаются отдельно от гидратной оболочки, «перескакивая» от одной группы неподвижно закрепленных молекул воды к другой. Их гидратная оболочка при этом последовательно обновляется. Поэтому основным фактором, определяющим скорость и энергию активации диффузии является кристаллографический радиус катиона.
Выводы
1. Показано, что кинетика ионного обмена катионов Hg2+ и Na+ подчиняется уравнению первого порядка. Значение энергии активации Ea составило 9,2±1,2 кДж·моль-1 соответственно. Рассчитаны значения констант скорости внешней диффузии катионов k в зависимости от температуры процесса и размера гранул ЖМК.
2. Низкое значение энергии активации и зависимость константы скорости от гранулометрического состава подтверждает то, что лимитирующей стадией процесса является внешняя диффузия.
3. Катионы металлов располагаются в следующий ряд подвижности:
|
Pb2+
|
< Hg2+
|
< Mn2+
|
< Ni2+
|
|
|
Еа, кДж/моль
|
14,64
|
9,27
|
7,43
|
7,15
|
|
k, c-1
|
9,910-5
|
3,910-4
|
0,93·10-3
|
1,710-3
|
В ряду повышается константа скорости внешней диффузии и понижается энергия активации. Ряд подвижности коррелирует с уменьшением кристаллографических радиусов катионов и не согласуется с ростом вдоль него радиусов катионов по Стоксу, что объясняется «проскоковым» механизмом диффузии.
Библиографический список
- Челищев Н.Ф., Грибанов Н.К., Новиков Г.В. Сорбционные свойства океанических железомарганцевых конкреций и корок // М.: Недра. 1992.- С. 7-23, 316.
- Краткий справочник физико-химических величин./ Под ред. А.А. Равделя и А.М. Пономаревой. Л.: Химия. 2002. С. 123, 130, 200. 232 231 с.
- Челищев Н.Ф., Грибанова Н.К., Новиков Г.В. // Обогащение руд. 1988. № 3. С. 32 – 34.
- Зарицкий В.П. // Конкреции и конкреционный анализ: Сб. статей. М.: Наука, 1977. С 84-89, 245 с.
- Новиков Г.В., Сироткина И.В. / Сорбционный механизм формирования химического состава океанских железомарганцевых рудных отложений. Журнал «Вестник Отделения наук о Земле РАН» №1(22) 2004 С. 38-42.
- Чиркст Д.Э., Черемисина О.В., Иванов М.В., Чистяков А.А., Жадовский И.Т., /Изотерма обмена катионов стронция и натрия на железомарганцевых конкрециях // ЖПХ. 2006. Т. 79. № 3. С.374-379.
- Чиркст Д.Э., Черемисина О.В., Иванов М.В., Чистяков А.А., Жадовский И.Т., / Изотерма обмена катионов никеля и натрия на поверхности.// ЖМК ЖПХ. 2006. Т. 79. № 7. С.1101-1105.
- Чиркст Д Э, Черемисина О В, Жадовский И Т, Иванов М В, Чистяков АА, /Кинетика сорбции катионов никеля на поверхности ЖМК// Известия вузов. Химия и хим.технология. 2006. Т.49. Вып.11. ст 405-410
- Чиркст Д.Э., Черемисина О.В., Иванов М.И., Чистяков А.А./ Изотерма СТРОНЦИЯ // ЖПХ. 2005, Т. 78. № 4. С. 599-605
- Д.Э. Чиркст, О.В. Черемисина, А.А. Чистяков, И.Т. Жадовский / Кинетика ионного обмена катионов свинца и натрия на поверхности железомарганцевых конкреций // Журнал прикладной химии. 2010. Т. 83. Вып. 9. С.1440-1443
- Березюк В.Г., Евтюхова О.В., Макурин Ю.Н.// В сб. «Научные исследования по экологии и рациональному природопользованию». СПб.: изд. СПГГИ (ТУ), 2000, С. 88-90.
